近日,中国农业科学院哈尔滨兽医研究所研究揭示了非洲猪瘟病毒免疫逃逸新机制, 阐明了缺失EP402R基因导致非洲猪瘟病毒毒力降低背后的分子机制。相关研究成果发表在《免疫学杂志(Journal of Immunology)》上。
非洲猪瘟(ASF)是由非洲猪瘟病毒(ASFV)引起的家猪、野猪的一种急性、热性、高度接触性动物传染病。目前,在我国流行的部分非洲猪瘟毒株因为其编码CD2v蛋白的EP402R基因发生了缺失或突变,导致ASFV的致病力降低。然而,EP402R基因影响ASFV致病力的分子机制尚不清楚。
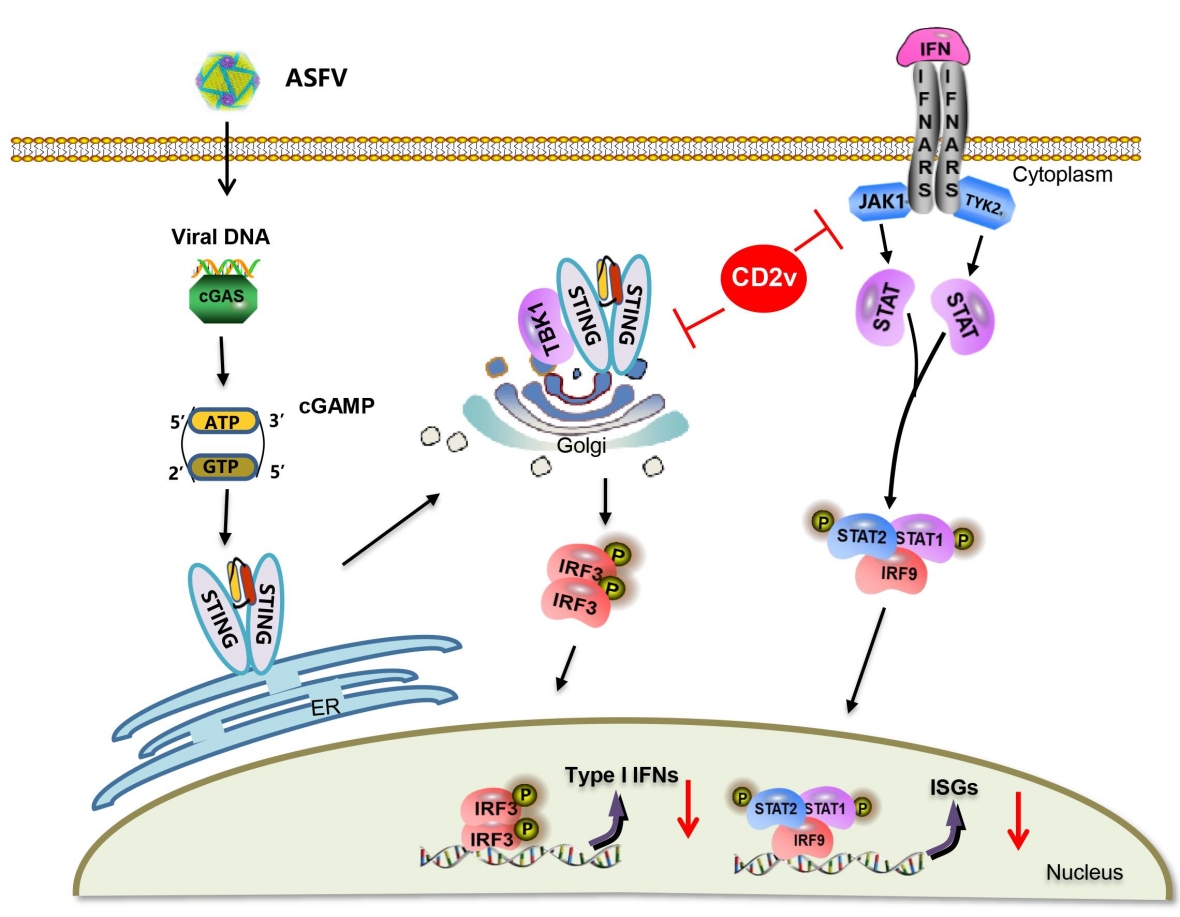
通过荧光定量PCR和酶联免疫吸附试验发现,与亲本病毒ASFV HLJ/18相比,EP402R基因敲除的毒株感染猪肺泡巨噬细胞产生更多的I型干扰素。进一步研究发现,EP402R基因编码的蛋白CD2v通过与IFN基因刺激因子(STING)的跨膜结构域相互作用,阻止了STING向高尔基体的运输,从而抑制I型干扰素的产生。同时,ASFV CD2v通过破坏干扰素受体与酪氨酸激酶2和JANUS激酶1的相互作用,从而抑制了IFN-α诱导的抗病毒基因的表达。动物实验结果表明,与ASFV HLJ/18株相比,EP402R基因缺失病毒ASFV-ΔEP402R感染无特定病原体(SPF)猪诱导产生更多的I型干扰素,ASFV-ΔEP402R对SPF猪的致病力显著减弱。该研究揭示了ASFV CD2v通过抑制Ⅰ型干扰素产生和干扰素信号通路影响ASFV致病力的分子机制,为阐明ASFV弱毒株的致弱机制提供参考。
该研究得到国家自然科学基金区域联合项目(U21A20256)、面上项目(32270156)和黑龙江省优秀青年基金(YQ2020C022)项目的资助。黄丽研究员、陈伟业研究员、博士后刘宏扬和硕士研究生薛梦迪为文章的共同第一作者,翁长江研究员和步志高研究员为文章的共同通讯作者。
原文标题及链接:
"African Swine Fever Virus HLJ/18 CD2v Suppresses Type I IFN Production and IFN-Stimulated Genes Expression through Negatively Regulating cGMP-AMP Synthase-STING and IFN Signaling Pathways"
https://pubmed.ncbi.nlm.nih.gov/?term="ASFV+CD2v&sort=date