近日,中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室冯力研究员领衔的猪消化道传染病创新团队,在猪传染性胃肠炎病毒(TGEV)调控抗病毒microRNA的研究中取得新进展,相关研究成果以“Coronavirus transmissible gastroenteritis virus antagonizes the antiviral effect of the microRNA miR-27b via the IRE1 pathway”为题,发表在《中国科学:生命科学(Science China Life Sciences)》上。该研究发现TGEV通过定位于内质网膜上的肌醇依赖内质网至细胞核信号激酶1(IRE1)途径抑制抗冠状病毒microRNA的表达,从而逃避宿主的免疫监视。
miRNA是一类由内源基因编码的长度约为18-36个核苷酸的非编码单链RNA分子,通过与靶标mRNA的3'端非翻译区(3'-UTR)特异性结合,从而引起靶标mRNA分子的降解或翻译抑制,在动植物中参与转录后基因表达调控。尽管研究人员对miRNAs的功能已有一定程度的探索,但这些分子在冠状病毒感染中的作用以及冠状病毒感染后调控miRNAs的分子机制仍不清楚。本研究发现miRNAs中的miR-27b-3p能够发挥广谱抗肠道病毒(猪传染性胃肠炎病毒(TGEV)、猪流行性腹泻病毒(PEDV)和猪轮状病毒(PoRV))的作用,并找到其靶标mRNA-猪细胞因子信号转导抑制因子6(SOCS6)。
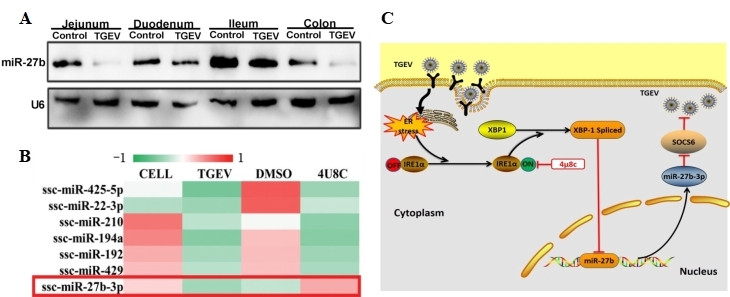
图1 TGEV拮抗miR-27b抗病毒作用的机制
TGEV是一种引起仔猪腹泻的肠道冠状病毒,在哺乳仔猪中引起高发病率和高死亡率。据薛美副研究员介绍,他们发现TGEV感染的细胞和仔猪肠道中miR-27b-3p的表达均明显下调(图1A)。进一步探索其机制,发现TGEV感染后大量病毒蛋白在内质网上合成、修饰和折叠,诱导细胞产生了内质网应激,其中定位于内质网膜上的IRE1编码一种有效的转录因子X盒结合蛋白1(Xbp1s)。Xbp1s抑制miR-27b-3p的转录并最终减少miR-27b-3p的产生(图1B和1C)。
TGEV对miR-27b-3p的抑制表达,使其靶标SOCS6大量表达,从而负反馈调节细胞因子信号传导,抑制抗病毒信号传导从而病毒可以在细胞内大量复制(图1)。本研究首次发现冠状病毒TGEV通过IRE1途径抑制具有广谱抗肠道病毒功能的miR-27b-3p的表达,从而逃避宿主的免疫监视,并对宿主造成严重损伤。
该研究得到了黑龙江省博士后基金(LBH-Z18207)和国家自然科学基金(31802198)以及中国农业科学院创新工程项目、黑龙江省领军人才团队项目等项目资助。
原文链接:https://doi.org/10.1007/s11427-021-1967-x