近日,中国农业科学院哈尔滨兽医研究所在蓝舌病病毒基因组进化与宿主免疫互作机制方面取得新进展,揭示了高CpG的虫媒病毒规避哺乳动物宿主免疫压力的新机制,相关研究成果发表在《细胞报告(Cell Reports)》上。
脊椎动物基因组中普遍存在CpG二核苷酸频率受抑制的现象。为适应宿主环境,多数哺乳动物专嗜病毒会模拟宿主的低CpG特征,而昆虫专嗜病毒则无此限制。然而,蓝舌病病毒(BTV)和流行性出血病病毒(EHDV)等多节段双链RNA虫媒病毒,却在基因组中保持较高的CpG含量。它们如何逃避哺乳动物的免疫抑制并实现有效感染,目前尚不明确。
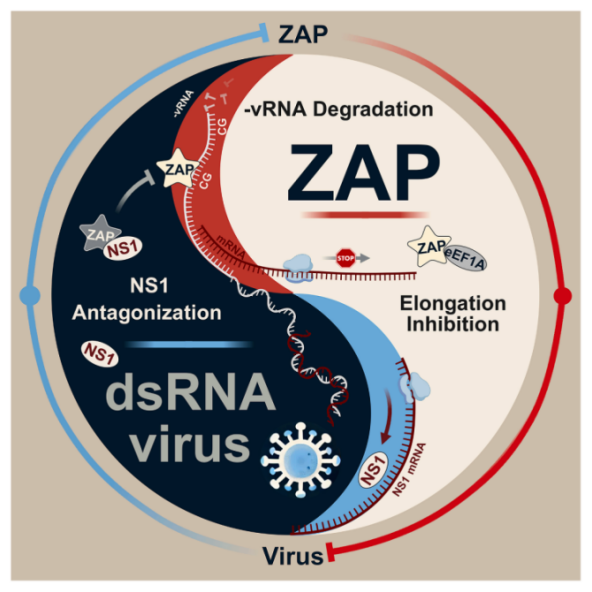
研究首次系统证实,哺乳动物宿主蛋白ZAP广泛抑制BTV和EHDV的复制,而对非虫媒传播的轮状病毒(RV)则无显著限制作用。该研究以BTV为模型,揭示了ZAP的双重限制机制:一方面,ZAP通过与真核翻译延伸因子1A结合,进而阻断病毒蛋白的翻译过程;另一方面,ZAP优先识别病毒基因组负链RNA,并介导其降解。值得注意的是,BTV基因组第五节段呈现低CpG特征,其编码的NS1蛋白通过竞争性结合病毒RNA,保护基因组免受识别与降解。提高该节段CpG频率后,突变病毒在体内外的复制能力均显著下降。该研究为基于CpG重编码策略开发新型减毒活疫苗提供了重要理论依据。
哈兽研牛羊传染病创新团队与荷兰瓦赫宁根大学联合培养博士研究生邵冉和硕士研究生郗灿坤为论文的第一作者,哈兽研尹鑫研究员和荷兰瓦赫宁根大学Jelke J.Fros教授为通讯作者。该研究得到了国家自然科学基金和国家重点研发计划等项目资助。
原文链接:DOI:10.1016/j.celrep.2025.116742