近日,中国农业科学院哈尔滨兽医研究所在非洲猪瘟病毒(ASFV)免疫逃逸机制研究上取得新进展,发现ASFV pB318L蛋白通过抑制干扰素产生和干扰素信号通路促进病毒复制的新机制。相关研究成果于近日发表在《PLoS Pathogens》杂志。
非洲猪瘟(ASF)是由ASFV引起的一种急性、出血性的严重传染病,对养猪业造成严重打击。由于缺乏安全、有效的商品化疫苗,ASF的防控形势依然严峻。ASFV基因组庞大,其编码蛋白逃逸宿主免疫应答的机制尚未阐明。深入研究ASFV的免疫逃逸基因并阐明其功能,将为ASF疫苗研发和疫情防控提供重要的科技支撑。
pB318L蛋白在ASFV复制和免疫调控中的作用未知。研究发现,与其亲本病毒ASFV HLJ/18比较, B318L基因突变的ASFV重组毒株(ASFV-intB318L)感染猪肺泡巨噬细胞产生更多的I型干扰素和干扰素刺激基因。进一步探究发现,pB318L与cGAS-STING信号通路中的STING相互作用抑制了STING从内质网向高尔基体的易位,从而抑制I型干扰素的产生。同时pB318L还与JAK-STAT信号通路中的干扰素受体结合,抑制干扰素刺激基因的产生。本研究为设计抗ASFV药物或减毒活疫苗提供了线索。
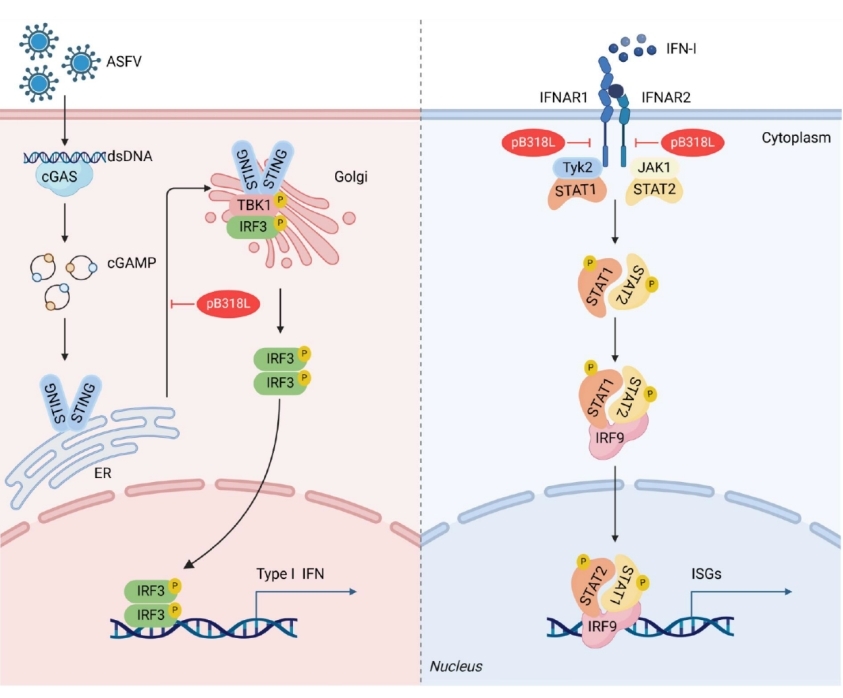
pB318L蛋白作用机制示意图
中国农业科学院哈尔滨兽医研究所博士研究生刘晓红和陈合凤为文章的共同第一作者,黄丽研究员、翁长江研究员和步志高研究员为共同通讯作者。本研究得到了国家自然科学基金项目(32322081、U21A20256、32270156)和中国农业科学院科学中心项目(CAAS-CSLPDCP-2023002)的资助。
文章标题及链接:“African swine fever virus pB318L, a trans-geranylgeranyl-diphosphate synthase, negatively regulates cGAS-STING and IFNAR-JAK-STAT signaling pathways”
https://journals.plos.org/plospathogens/article?id="10.1371/journal.ppat.1012136